효소는 생명체 내에서 화학 반응을 촉진하는 생체 촉매로서, 반응의 활성화 에너지를 낮추어 반응 속도를 증가시킵니다. 활성화 에너지는 화학 반응이 시작되기 위해 필요한 최소한의 에너지로, 반응물들이 전이 상태에 도달하는 데 요구됩니다. 효소는 다양한 메커니즘을 통해 이 활성화 에너지를 낮추며, 그 원리는 다음과 같이 설명할 수 있습니다.

1. 효소와 기질의 결합:
효소는 특정한 기질과 결합하여 효소-기질 복합체를 형성합니다. 이 결합은 주로 효소의 활성 부위에서 이루어지며, 활성 부위는 기질의 구조와 상보적인 형태를 가집니다. 이러한 특이적인 결합은 기질을 정확하게 인식하고 결합할 수 있게 합니다.

2. 전이 상태의 안정화:
화학 반응에서 전이 상태는 반응물이 생성물로 변환되는 과정에서 가장 높은 에너지 상태를 의미합니다. 효소는 기질을 전이 상태에 가깝게 변형시키거나, 전이 상태 자체를 안정화시켜 이 에너지 장벽을 낮춥니다. 이를 통해 반응이 더 적은 에너지로 진행될 수 있습니다.

3. 반응 경로의 변화:
일부 효소는 반응이 진행되는 경로를 변경하여, 활성화 에너지가 더 낮은 새로운 경로를 제공합니다. 예를 들어, 기질을 활성 부위에 결합시켜 반응 중간체를 형성하거나, 반응을 단계별로 진행시켜 각 단계의 에너지 장벽을 낮출 수 있습니다
4. 기질의 물리적 변형:
효소는 기질의 결합을 통해 기질의 구조를 물리적으로 변형시킬 수 있습니다. 이러한 변형은 결합의 장력을 증가시키거나, 특정 결합을 약화시켜 반응이 더 쉽게 일어나도록 돕습니다.
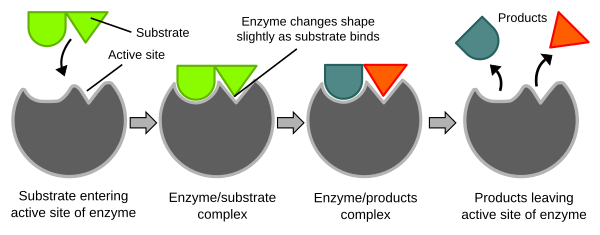
5. 반응 환경의 최적화:
효소는 활성 부위에서 반응이 일어나는 미세 환경을 조절하여, 반응에 적합한 pH, 극성, 전하 상태 등을 제공합니다. 이를 통해 기질이 반응하기에 최적의 조건을 만들어 활성화 에너지를 낮춥니다.
6. 기질의 정렬 및 근접성 증가:
효소는 두 개 이상의 기질이 반응해야 하는 경우, 이들을 정확한 방향과 근접성으로 정렬시켜 반응이 더 효율적으로 일어나게 합니다. 이러한 공간적 배열은 반응의 활성화 에너지를 감소시키는 데 기여합니다.
'정보 > 생명 과학' 카테고리의 다른 글
| NAD 효소에 대해서, 구조 (0) | 2025.04.29 |
|---|---|
| 심해의 환경, 심해 물고기는 어떻게 수압을 견딜까 (1) | 2025.04.26 |
| 전기뱀장어는 어떻게 전기를 만들까? 감전되면 죽을수도 있을까? (0) | 2025.04.18 |
| 불멸의 해파리, 영원히 살 수 있는 해파리 (0) | 2025.04.13 |
| 늙지 않는 동물들, 영원히 사는 동물 (0) | 2025.04.12 |




댓글